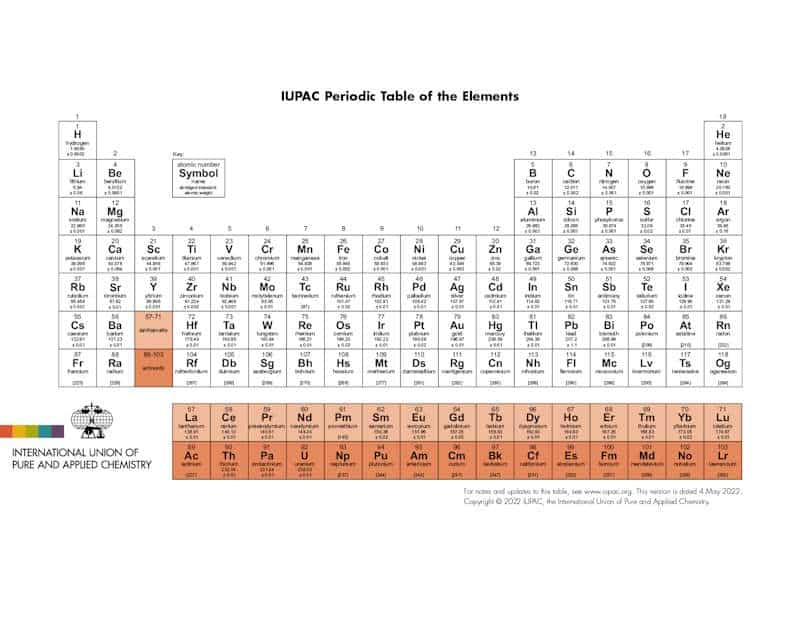
Det periodiske system* – historie, struktur og didaktiske greb
Det periodiske system er kemiens “landkort”: en kompakt oversigt over, hvordan grundstoffernes egenskaber varierer og gentager sig. Nedenfor får du en gennemarbejdet introduktion til systemets tilblivelse, nøgletænkere bag, moderne udvidelser og konkrete idéer til, hvordan du kan arbejde med periodiske trends i undervisningen – inkl. forslag til relevante produkter fra webshoppen.
*)
-
“Det periodiske system” er den mest almindelige og udbredte betegnelse i både daglig tale, undervisning og lærebøger. Den bruges næsten altid i gymnasiet og i populærvidenskabelig sammenhæng.
-
“Grundstoffernes periodesystem” er en mere formel og præcis betegnelse, som understreger, at det er grundstofferne, der er ordnet i systemet. Den bruges bl.a. i nogle fagbøger, i officielle sammenhænge og tidligere i undervisningsmaterialer.
Allerede i første halvdel af 1800-tallet begyndte kemikere at ane mønstre. Den tyske kemiker Johann W. Döbereiner samlede i 1829 flere “triader” – grupper af tre elementer med lignende egenskaber, hvor den midterstes masse og egenskaber lå tæt på gennemsnittet af de to andre (fx Ca–Sr–Ba). Triaderne var forløbere for dagens grupper (lodrette søjler).
John A. R. Newlands gik i 1860’erne skridtet videre og arrangerede elementerne efter stigende atommasse. Han bemærkede, at egenskaber gentog sig for hver ottende – analogt med musikkens oktaver – og døbte relationen “Law of Octaves”. I sit brev af 8. august 1865 formulerede han: “This peculiar relationship I propose to provisionally term the ‘Law of Octaves.’”
Næsten samtidig arbejdede Lothar Meyer og Dmitrij Mendelejev på mere komplette tabeller. Mendelejev præsenterede i 1869 en version, hvor han efterlod tomme pladser og forudså egenskaberne for endnu ukendte grundstoffer (fx gallium, scandium, germanium). Denne forudsigelseskraft gjorde hans system ekstra overbevisende. (Historikere påpeger, at “den drøm”, hvor Mendelejev skulle have set hele tabellen for sig, er en god anekdote – men næppe hele forklaringen).
Et afgørende moderniseringsspring kom i 1913, da Henry Moseley påviste, at den rigtige ordningsnøgle ikke er atommasse, men atomnummer (antal protoner). Moseleys røngen-målinger viste en lineær sammenhæng mellem atomnummer og linjefrekvenser – og cementerede den moderne Periodiske Lov.
I 1940’erne foreslog Glenn T. Seaborg den nu standardiserede placering af aktiniderne som en separat række under lanthaniderne – den såkaldte actinide concept – hvilket ommøblerede tungmetalområdet og guidede jagten på transurane elementer.
Hvordan er tabellen bygget op – og hvorfor virker den?
-
Perioder (rækker): Når vi går fra venstre mod højre, fyldes elektronskaller/orbitaler op; atomradius falder typisk, ioniseringsenergi og elektronegativitet stiger.
-
Grupper (kolonner): Elementer i samme gruppe har ens valenselektron-konfiguration og derfor beslægtet kemi (fx alkalimetaller i gruppe 1 og halogener i gruppe 17).
-
Blokke (s-, p-, d-, f-): Afhænger af hvilken orbital der fyldes; f-blokken rummer lanthanider og aktinider – Seaborgs store bidrag.
De nyeste grundstoffer (7. periode komplet)
I 2016 godkendte IUPAC de permanente navne for element 113, 115, 117 og 118:
Nihonium (Nh), Moscovium (Mc), Tennessine (Ts) og Oganesson (Og). Beslutningen fulgte en verifikationsproces, der begyndte i 2015, og fuldendte 7. periode i tabellen.
-
Nihonium (113) – navn efter “Nihon” (Japan).
-
Moscovium (115) – efter Moskva-regionen.
-
Tennessine (117) – efter Tennessee (Oak Ridge m.fl.).
-
Oganesson (118) – for at hædre Yuri Oganessian.
Disse supertunge, kunstigt fremstillede grundstoffer eksisterer kun i meget korte tider før henfald – men de tester og udvider vores forståelse af atomkernefysik og den periodiske trends robusthed.
“Sæt gang i tankerne” citater
-
John Newlands (1865): “This peculiar relationship I propose to provisionally term the ‘Law of Octaves.’” (originalt brev)
-
Glenn T. Seaborg (om aktinid-reformen): I sin egen retrospektive tekst fremhæver han 1944-idéen som en af de største ommøbleringer af tabellen siden Mendelejev – en ændring, der “viser, hvordan de transuraniske elementer passer ind i det periodiske system.”
-
(Anekdotisk) Mendelejev: Han skal have sagt, at han “så en tabel, hvor alle elementer faldt på plads”, efter et kort blund under intenst arbejde – en god indgang til at tale om kreativitet i naturvidenskab, men brug den med kildekritik.
Læs mere på IUPAC , hvor du også kan downloade et gratis periodisk system.